A ESTRUTURA E FUNÇÃO DA MICROBIOTA HUMANA DO INTESTINO DELGADO: COMPREENSÃO ATUAL E DIREÇÕES FUTURAS - CONHEÇA A RELAÇÃO DA IMUNIDADE COM O INTESTINO
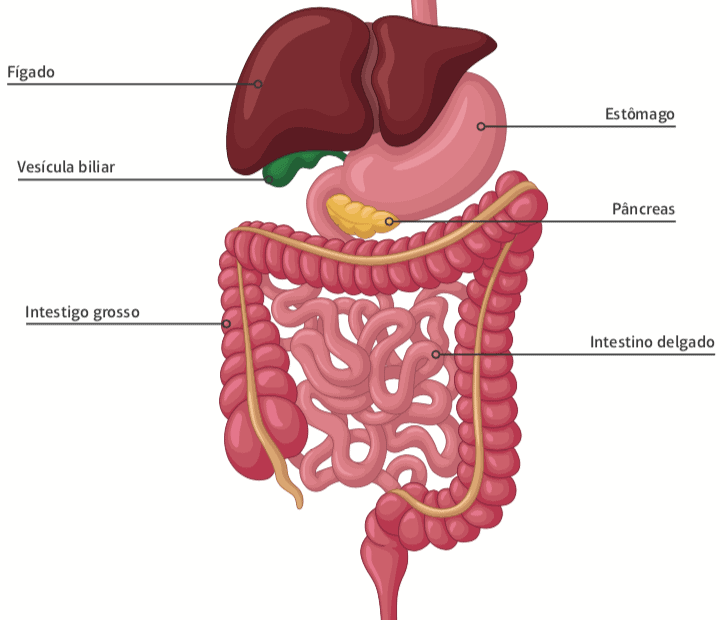
Anatomia do intestino e suas glândulas acessórias.
A Estrutura e Função da Microbiota Humana do Intestino Delgado: Compreensão Atual e Direções Futuras
Apesar do crescimento da literatura que caracteriza o microbioma fecal e sua associação com saúde e doença, poucos estudos analisaram o microbioma do intestino delgado. Aqui, examinamos o que se sabe sobre a microbiota do intestino delgado humano em termos de estrutura da comunidade e propriedades funcionais. Nós examinamos a dinâmica temporal de selecionar populações bacterianas no intestino delgado e os efeitos dos carboidratos e gorduras da dieta na formação dessas populações. Em seguida, avaliamos a disbiose no intestino delgado em vários modelos de doenças humanas, incluindo crescimento excessivo de bactérias no intestino delgado, síndrome do intestino curto, bolsite, disfunção entérica ambiental e síndrome do intestino irritável. O que está claro é que a biologia bacteriana e os mecanismos da fisiopatologia induzida por bactérias são enormemente amplos e elegantes no intestino delgado. O estudo da microbiota do intestino delgado é desafiado pelas condições ambientais de flutuação rápida nesses segmentos intestinais, bem como pela complexidade da coleta de amostras e da análise bioinformática. Como a funcionalidade do trato digestivo é determinada principalmente pelo intestino delgado, esforços devem ser feitos para caracterizar melhor esse ecossistema microbiano único e importante.
Palavras-chave
Abreviações usadas neste artigo:
BA ( ácido biliar ), CFU ( unidades formadoras de colônia ), EED ( disfunção entérica ambiental ), FAP ( polipose adenomatosa familiar ), FXR ( receptor farnesóide X ), GF ( livre de germes ), HF ( alto teor de gordura ), IBD ( doença inflamatória do intestino ), IBS ( síndrome do intestino irritável ), IPAA ( bolsa ileal-anastomose anal ), PN (nutrição parenteral ), SBS ( síndrome do intestino curto ), SIBO ( crescimento excessivo de bactérias no intestino delgado ), UC ( colite ulcerosa )Desafios metodológicos no estudo da microbiota do intestino delgado
A Diversidade e Dinâmica Temporal da Microbiota do Intestinal Delgado


Influências dietéticas nas estruturas e funções da comunidade
Carboidratos e a microbiota do intestino delgado
Gordura dietética e microbiota do intestino delgado
| Nutriente | Mecanismo |
|---|---|
| Digestão de carboidratos | Degradação e fermentação de carboidratos simples derivados da dieta em ácidos orgânicos, aldeídos, álcoois e gases Atividade de dissacaridase de borda em escova prejudicada O sulfeto de hidrogênio e o gás hidrogênio contribuem para a regulação da motilidade intestinal por meio de efeitos no músculo liso |
| Digestão de gordura e fisiologia dos ácidos biliares | Biliar desconjugação de ácidos, diminuição da bílis piscina ácido para o chumbo solubilização de gordura a esteatorreia ácido biliar (por exemplo, ácido litocólico) pode absorção directamente inibem, levando a esteatorreia Induzir peristaltismo intestinal e contracções mediadas por Takeda acoplados à proteína G Receptores 5 em neurónios entéricos e células enteroendócrinas (ácido desoxicólico) As piscinas de ácidos biliares secundários estimulam a secreção de cloreto e água |
| Armazenamento de micronutrientes | Os estoques de vitamina K podem ser aumentados devido à síntese bacteriana Consumo direto de bactérias para vitamina B12 e modificação para uso como próprio cofator Inibição induzida por anaeróbio da absorção de vitamina B12 no íleo terminal Deficiência de vitaminas solúveis em gordura de ácidos biliares desconjugados, diminuição da absorção de gordura |
Micronutrientes e a microbiota do intestino delgado
Modelos de doença de disbiose no intestino delgado
Síndrome do intestino curto
Pouchitis
Disfunção entérica ambiental
Síndrome do intestino irritável
Conclusões
Referências
- Microbioma intestinal central em gêmeos obesos e magros.Natureza. 2009; 457 : 480-484
- Paisagem de variação genômica do microbioma intestinal humano.Natureza. 2013; 493 : 45-50
- Microbioma intestinal humano visto em todas as idades e geografias.Natureza. 2012; 486 : 222-227
- Comunidades microbianas no intestino delgado humano: diversidade de acoplamento à metagenômica.Future Microbiol. 2007; 2 : 285-295
- Intestino delgado e microbiota.Curr Opin Gastroenterol. 2011; 27 : 99-105
- Anatomia e fisiologia do intestino delgado.Gastrointest Endosc Clin N Am. 2017; 27 : 1-13
- Enterótipos do microbioma intestinal humano.Natureza. 2011; 473 : 174-180
- A análise independente da cultura da mucosa ileal revela um aumento seletivo na Escherichia coli invasiva de nova filogenia em relação à depleção de Clostridiales na doença de Crohn envolvendo o íleo.ISME J. 2007; 1 : 403-418
- Comparação da diversidade bacteriana ao longo do trato intestinal humano por clonagem direta e sequenciamento de genes 16S rRNA.FEMS Microbiol Ecol. 2005; 54 : 219-231
- Estudos com gêmeos revelam desequilíbrios específicos na microbiota associada à mucosa de pacientes com doença de Crohn ileal.Inflamm Bowel Dis. 2009; 15 : 653-660
- Diversidade bacteriana associada à mucosa em relação ao íleo terminal humano e amostras de biópsia do cólon.Appl Environ Microbiol. 2007; 73 : 7435-7442
- O microbioma intestinal humano adota um estado alternativo após o transplante de intestino delgado.Proc Natl Acad Sci US A. 2009; 106 : 17187-17192
- Análise molecular da microbiota colônica humana jejunal, ileal, cecal e reto-sigmoidal usando bibliotecas de genes rRNA 16S e polimorfismo de comprimento de fragmento de restrição terminal.J Med Microbiol. 2005; 54 : 1093-1101
- Estudos de microflora intestinal. 4. A microflora do efluente da ileostomia: uma ecologia microbiana única.Gastroenterology. 1967; 53 : 874-880
- Alta variação temporal e interindividual detectada na microbiota ileal humana.Environ Microbiol. 2010; 12 : 3213-3227
- A análise genômica comparativa de isolados de Streptococcus do intestino delgado humano revela sua adaptação a um ecossistema altamente dinâmico.PLoS One. 2013; 8 e83418
- Diversidade de populações de Streptococcus e Veillonella do intestino delgado humano.FEMS Microbiol Ecol. 2013; 85 : 376-388
- A microbiota do intestino delgado humano é impulsionada pela rápida absorção e conversão de carboidratos simples.ISME J. 2012; 6 : 1415-1426
- Indo além das associações de todo o microbioma para a identificação causal do micróbio.Natureza. 2017; 552 : 244-247
- Modelos de camundongos para pesquisa da microbiota intestinal humana: uma avaliação crítica.Cell Mol Life Sei. 2018; 75 : 149-160
- Disbiose e seus descontentamentos.MBio. 2017; 8
- Microflora do intestino delgado humano.Am J Surg. 1979; 138 : 845-850
- Populações bacterianas que contaminam o intestino superior em pacientes com síndrome de supercrescimento bacteriano no intestino delgado.Am J Gastroenterol. 1999; 94 : 1327-1331
- A microbiota específica dirige a diferenciação de células T auxiliares produtoras de IL-17 na mucosa do intestino delgado.Cell Host Microbe. 2008; 4 : 337-349
- Microflora ileal em pacientes cirúrgicos.J Urol. 1971; 105 : 351-353
- Supercrescimento bacteriano jejunal e permeabilidade intestinal em crianças com síndromes de imunodeficiência.Intestino. 1990; 31 : 879-882
- Imunidade e morfometria da mucosa do intestino delgado no crescimento luminal da flora intestinal indígena.Am J Gastroenterol. 2001; 96 : 494-500
- Diversidade de alto rendimento e análise da funcionalidade da microbiota do trato gastrointestinal.Intestino. 2008; 57 : 1605-1615
- Variação orgânica, genética e transcricional nos microbiomas intestinais profundamente sequenciados de gêmeos idênticos.Proc Natl Acad Sci US A. 2010; 107 : 7503-7508
- Análise comparativa da microbiota intestinal humana por pirosequenciamento com código de barras.PLoS One. 2008; 3 e2836
- Análise molecular da microbiota bacteriana no estômago humano.Proc Natl Acad Sci US A. 2006; 103 : 732-737
- Comunicação entre espécies em biofilmes de Streptococcus gordonii-Veillonella atypica: a sinalização em condições de fluxo requer justaposição.Proc Natl Acad Sci US A. 2004; 101 ( 16917-1622 )
- Camundongos C57BL / 6J livres de germes são resistentes à resistência à insulina induzida por dieta rica em gordura e apresentam metabolismo do colesterol alterado.FASEB J. 2010; 24 : 4948-4959
- A microbiota do intestino delgado regula as respostas adaptativas e digestivas do hospedeiro aos lipídios da dieta.Cell Host Microbe. 2018; 23 : 458-469 e5
- A dieta domina o genótipo do hospedeiro na formação da microbiota intestinal murina.Cell Host Microbe. 2015; 17 : 72-84
- A dieta altera de forma rápida e reproduzível o microbioma intestinal humano.Natureza. 2014; 505 : 559-563
- A composição da fonte de gordura dietética molda a arquitetura da microbiota intestinal e altera os mediadores inflamatórios do hospedeiro no tecido adiposo de camundongos.JPEN J Parenter Enteral Nutr. 2013; 37 : 746-754
- Modulação dependente de FXR do microbioma do intestino delgado humano pelo ácido biliar derivado do ácido obeticólico.Gastroenterology. 2018; 155 : 1741-1752.e5
- Papel dos ácidos biliares no eixo intestino-fígado.J Hepatol. 2018; 68 : 1083-1085
- A interação entre bactérias e bile.FEMS Microbiol Rev. 2005; 29 : 625-651
- Agonistas de FXR como agentes terapêuticos para doença hepática gordurosa não alcoólica.Curr Atheroscler Rep. 2015; 17 : 500
- A microbiota intestinal regula o metabolismo do ácido biliar reduzindo os níveis de ácido tauro-beta-muricólico, um antagonista de FXR que ocorre naturalmente.Cell Metab. 2013; 17 : 225-235
- Modulação microbiana intestinal sistêmica do metabolismo dos ácidos biliares em compartimentos de tecido do hospedeiro.Proc Natl Acad Sci US A. 2011; 108 : 4523-4530
- A remodelação do microbioma leva à inibição da sinalização do receptor farnesóide X intestinal e diminuição da obesidade.Nat Commun. 2013; 4 : 2384
- O ácido taurocólico induzido pela gordura na dieta promove a expansão de patobiontes e colite em camundongos Il10 - / -.Natureza. 2012; 487 : 104-108
- A contribuição das bactérias redutoras de sulfato e do ácido 5-aminossalicílico para o sulfeto fecal em pacientes com colite ulcerosa.Intestino. 2000; 46 : 64-72
- Triagem de bactérias redutoras de sulfato em amostras de colonoscopia de mucosa intestinal humana saudável e colítica.FEMS Microbiol Ecol. 2000; 34 : 147-155
- Absorção, armazenamento e mobilização da vitamina A.Subcell Biochem. 2016; 81 : 95-125
- Absorção intestinal da vitamina solúvel em gordura: locais de absorção no intestino e interações para absorção.Food Chem. 2015; 172 : 155-160
- Tendências recentes no metabolismo e biologia celular da vitamina K, com referência especial ao ciclo da vitamina K e biossíntese de MK-4.J Lipid Res. 2014; 55 : 345-362
- Supercrescimento bacteriano no intestino delgado e variabilidade da necessidade de dose de varfarina.Thromb Res. 2010; 126 : 12-17
- A interação entre crescimento excessivo de bactérias no intestino delgado e tratamento com varfarina.Am J Gastroenterol. 2009; 104 : 2364-2365
- Importância das bactérias anaeróbias na má absorção de cobalamina na síndrome experimental da alça cega em ratos.Gastroenterology. 1981; 80 : 313-320
- Para B12 ou não para B12: cinco questões sobre o papel da cobalamina nas interações hospedeiro-microbiana.PLoS Pathog. 2019; 15 e1007479
- Bacteroides do intestino humano capturam vitamina B12 por meio de lipoproteínas expostas à superfície celular.Elife. 2018; 7
- Supercrescimento bacteriano gastrointestinal: patogênese e significado clínico.Ther Adv Chronic Dis. 2013; 4 : 223-231
- Diverticulose do intestino delgado: percepções e realidade.J Am Coll Surg. 1997; 184 : 383-388
- Causas da má absorção após gastrectomia total com reconstrução em Y de Roux.Acta Chir Scand. 1988; 154 : 37-41
- Síndrome da alça estagnada resultante de lesão por irradiação do intestino delgado e desvio intestinal.Gynecol Oncol. 1974; 2 : 441-445
- Trânsito gastrointestinal pelo esôfago, estômago, intestino delgado e grosso em pacientes com esclerose sistêmica progressiva.Dig Dis Sci. 1994; 39 : 2209-2215
- Síndrome de supercrescimento bacteriano no intestino delgado.World J Gastroenterol. 2010; 16 : 2978-2990
- Revisão abrangente sobre o metabolismo do lactato na saúde humana.Mitocôndria. 2014; 17 : 76-100
- Acidose D-láctica: transformação do açúcar em ácidos no trato gastrointestinal.Kidney Int. 1996; 49 : 1-8
- Supercrescimento bacteriano no intestino delgado: implicações nutricionais, diagnóstico e manejo.Gastroenterol Clin North Am. 2018; 47 : 193-208
- O diagnóstico de supercrescimento bacteriano do intestino delgado. Confiabilidade da cultura jejunal e inadequação do teste de hidrogênio expirado.Gastroenterology. 1990; 98 : 302-309
- Experiência em 49 procedimentos de alongamento intestinal longitudinal para síndrome do intestino curto.Eur J Pediatr Surg. 2006; 16 : 171-175
- Probióticos, acidose D-láctica, estresse oxidativo e especificidade de cepas.Micróbios intestinais. 2017; 8 : 311-322
- Alterações microbianas e metabólicas intestinais após transplante de microbiota fecal com sucesso para acidose D-láctica.J Pediatr Gastroenterol Nutr. 2018; 67 : 483-487
- Má absorção, tempo de trânsito orocecal e supercrescimento bacteriano no intestino delgado em pacientes diabéticos tipo 2: uma conexão.Indian J Clin Biochem. 2017; 32 : 84-89
- Densidade mineral óssea em pacientes com crescimento excessivo de bactérias no intestino delgado.Hepatogastroenterology. 2003; 50 : 1415-1418
- Uma revisão sistemática de testes de diagnóstico para crescimento excessivo de bactérias no intestino delgado.Dig Dis Sci. 2008; 53 : 1443-1454
- Teste de respiração à base de hidrogênio e metano em distúrbios gastrointestinais: o consenso norte-americano.Am J Gastroenterol. 2017; 112 : 775-784
- Efeitos dos micróbios intestinais na absorção de nutrientes e regulação de energia.Nutr Clin Pract. 2012; 27 : 201-214
- Supercrescimento bacteriano no intestino delgado: aspiração duodenal vs teste respiratório de glicose.Neurogastroenterol Motil. 2015; 27 : 481-489
- Síndrome do intestino curto neonatal como modelo de insuficiência intestinal: antecedentes fisiológicos para alimentação enteral.Clin Nutr. 2013; 32 : 162-171
- O microbioma fecal em pacientes pediátricos com síndrome do intestino curto.JPEN J Parenter Enteral Nutr. 2016; 40 : 1106-1113
- A disbiose intestinal em crianças com síndrome do intestino curto está associada a resultados prejudicados.Microbiome. 2015; 3 : 18
- Alterações drásticas na microbiota fecal e associada à mucosa em pacientes adultos com síndrome do intestino curto.Biochimie. 2010; 92 : 753-761
- A ressecção intestinal extensa desencadeia adaptação comportamental, remodelação intestinal e transição da microbiota na síndrome do intestino curto.Microorganismos. 2016; 4
- A relação D / L de lactato fecal é uma assinatura metabólica do desequilíbrio da microbiota em pacientes com síndrome do intestino curto.PLoS One. 2013; 8 e54335
- A microbiota está envolvida na adaptação pós-ressecção em humanos com síndrome do intestino curto.Front Physiol. 2017; 8 : 224
- A taxa de infecção da corrente sanguínea é alta em bebês com síndrome do intestino curto: relação com crescimento excessivo de bactérias no intestino delgado, alimentação enteral e respostas inflamatórias e imunológicas.J Pediatr. 2010; 156 : 941-947 e1
- Fatores de risco para supercrescimento bacteriano no intestino delgado e rendimento diagnóstico de aspirados duodenais em crianças com insuficiência intestinal: uma revisão retrospectiva.J Pediatr Surg. 2012; 47 : 1150-1154
- Influência do supercrescimento bacteriano e da inflamação intestinal na duração da nutrição parenteral em crianças com síndrome do intestino curto.J Pediatr. 1997; 131 : 356-361
- Alterações na ultraestrutura da junção rígida em um modelo de rato de privação de nutrientes enteral.Dig Dis Sci. 2016; 61 : 1524-1533
- Hale LP Interações bacteriano-mucosas na doença inflamatória intestinal: uma aliança que deu errado.Am J Physiol Gastrointest Liver Physiol. 2008; 295 : G1139-G1149
- Assinaturas da microbiota intestinal associadas à esteatose hepática histológica na insuficiência intestinal de início pediátrico.JPEN J Parenter Enteral Nutr. 2017; 41 : 238-248
- Etiologia e prognóstico da síndrome do intestino curto pediátrico.Semin Pediatr Surg. 2018; 27 : 209-217
- Especificidades da microbiota fecal na doença inflamatória intestinal.Inflamm Bowel Dis. 2006; 12 : 106-111
- Vida após a cirurgia: avaliação da qualidade de vida do cirurgião em pacientes com polipose adenomatosa familiar.Dis Colon Rectum. 2018; 61 : 1217-1222
- Patogênese e hipótese unificadora da bolsite idiopática.Am J Gastroenterol. 2009; 104 : 1013-1023
- Disbiose na bolsite: evidência de padrões microflorais únicos na inflamação da bolsa.Clin Gastroenterol Hepatol. 2007; 5 : 352-360
- A bacteriologia da bolsite: uma análise filogenética molecular usando clonagem e sequenciamento do gene 16S rRNA.Ann Surg. 2010; 252 : 90-98
- Microbioma distinto na bolsite em comparação com bolsas saudáveis na colite ulcerosa e polipose adenomatosa familiar.Inflamm Bowel Dis. 2011; 17 : 1092-1100
- Expressão de sulfomucina em bolsas ileais: diferenças emergentes entre colite ulcerativa e bolsas de polipose adenomatosa familiar.Dis Colon Rectum. 2008; 51 : 561-567
- Uma caracterização da colonização anaeróbia e adaptações mucosas associadas na bolsa ileal não morta.Colorretal Dis. 2005; 7 : 563-570
- A população bacteriana move-se em direção a uma comunidade semelhante ao cólon na bolsa após a proctocolectomia total.Cirurgia. 2009; 145 : 435-447
- Análise multifásica do desenvolvimento temporal da microbiota intestinal distal em pacientes após anastomose anal com bolsa ileal.Microbiome. 2013; 1 : 9
- Características da mucosa das bolsas ileais pélvicas.Intestino. 1991; 32 : 61-65
- Efeitos do fluxo fecal e estase na mucosa da bolsa ileal.Intestino. 1991; 32 : 1166-1169
- Proctocolectomia restauradora com reservatório ileal: estudo patológico e histoquímico de espécimes de biópsia de mucosa.J Clin Pathol. 1987; 40 : 601-607
- Re: Levine et al. Produção de sulfeto de hidrogênio fecal na colite ulcerosa.Am J Gastroenterol. 1998; 93 : 2638
- Produção de sulfeto de hidrogênio fecal na colite ulcerosa.Am J Gastroenterol. 1998; 93 : 83-87
- Judeus Ashkenazi, gases de enxofre e colite ulcerosa.J Clin Gastroenterol. 1996; 22 : 288-291
- Bactérias redutoras de sulfato colonizam bolsas formadas para colite ulcerativa, mas não para polipose adenomatosa familiar.Dis Colon Rectum. 2002; 45 : 384-388
- Bactérias intestinais que previnem deficiências de crescimento transmitidas pela microbiota de crianças desnutridas.Ciência. 2016;: 351
- Antibióticos como parte do tratamento da desnutrição aguda grave.N Engl J Med. 2013; 368 : 425-435
- Disfunção entérica ambiental: uma definição de caso para ensaios de intervenção.Am J Trop Med Hyg. 2017; 97 : 1643-1646
- Disfunção entérica ambiental: patogênese, diagnóstico e consequências clínicas.Clin Infect Dis. 2014; 59 : S207-S212
- Disfunção entérica ambiental em crianças.J Pediatr Gastroenterol Nutr. 2016; 63 : 6-14
- Biomarcadores de enteropatia ambiental, inflamação, retardo de crescimento e crescimento prejudicado em crianças no nordeste do Brasil.PLoS One. 2016; 11 e0158772
- Biomarcadores de inflamação sistêmica e crescimento na primeira infância estão associados à baixa estatura em crianças pequenas da Tanzânia.Nutrientes. 2018; 10
- Idade e normalização do sexo das medidas de permeabilidade intestinal para a avaliação aprimorada da enteropatia na primeira infância: resultados do estudo MAL-ED.J Pediatr Gastroenterol Nutr. 2017; 65 : 31-39
- O déficit de crescimento em crianças rurais da Gâmbia está associado ao comprometimento da função da barreira do intestino delgado, levando à endotoxemia e inflamação sistêmica.J Nutr. 2003; 133 : 1332-1338
- A integridade intestinal anormal está associada ao crescimento linear reduzido em crianças rurais do Malawi.J Pediatr Gastroenterol Nutr. 2012; 55 : 747-750
- Função de barreira intestinal em pacientes desnutridos.Intestino. 1998; 42 : 396-401
- Enteropatia ambiental e desnutrição: sabemos o suficiente para intervir ?.BMC Med. 2014; 12 : 187
- A modulação cruzada de vias específicas do patógeno aumenta a desnutrição durante a coinfecção entérica com Giardia lamblia e Escherichia coli enteroagregativa.PLoS Pathog. 2017; 13 e1006471
- A deficiência de zinco altera a resposta do hospedeiro e a virulência do patógeno em um modelo de camundongo com diarreia induzida por Escherichia coli enteroagregativa.Micróbios intestinais. 2014; 5 : 618-627
- O papel crítico do zinco em um novo modelo murino de diarreia por E. coli enterotoxigênica (ETEC).Infect Immun. 2018; 86
- Novos modelos in vitro e in vivo e novas terapêuticas potenciais para quebrar o ciclo vicioso de infecção e desnutrição por Cryptosporidium.J Infect Dis. 2012; 205 : 1464-1471
- Supercrescimento bacteriano no intestino delgado e enteropatia ambiental em crianças de Bangladesh.MBio. 2016; 7 : e02102-e02115
- Teste do hidrogênio respiratório no diagnóstico de enteropatia ambiental em crianças residentes em uma favela urbana.Dig Dis Sci. 2007; 52 : 1253-1258
- Produção de metano e crescimento excessivo de bactérias no intestino delgado em crianças que vivem em uma favela.World J Gastroenterol. 2012; 18 : 5932-5939
- Vísceras famintas: alterações intestinais morfológicas e funcionais na desnutrição.J Pediatr Gastroenterol Nutr. 2017; 65 : 491-495
- Dieta e características específicas de gatilho de exposição microbiana de enteropatia ambiental em um novo modelo murino.Nat Commun. 2015; 6 : 7806
- G. lamblia persistente prejudica o crescimento em um modelo de desnutrição murina.J Clin Invest. 2013; 123 : 2672-2684
- Escherichia coli enteroagregativa (EAEC) prejudica o crescimento, enquanto a desnutrição piora a infecção EAEC: um novo modelo murino do ciclo de desnutrição da infecção.J Infect Dis. 2010; 202 : 506-514
- O priming de Cryptosporidium é mais eficaz do que a vacina para proteção contra criptosporidiose em um modelo de desnutrição protéica murina.PLoS Negl Trop Dis. 2016; 10 e0004820
- Dispepsia funcional e síndrome do intestino irritável: além de Roma IV.Dig Dis. 2017; 35 : 14-17
- Prevalência e preditores de supercrescimento bacteriano do intestino delgado na síndrome do intestino irritável: uma revisão sistemática e meta-análise.J Gastroenterol. 2018; 53 : 807-818
- Terapia com rifaximina para pacientes com síndrome do intestino irritável sem constipação.N Engl J Med. 2011; 364 : 22-32
- Contagens mais baixas de Bifidobactérias na microbiota associada à mucosa duodenal e fecal em pacientes com síndrome do intestino irritável.World J Gastroenterol. 2009; 15 : 2887-2892
- Diferenças de microbiota no intestino delgado e fezes entre pacientes com síndrome do intestino irritável e indivíduos saudáveis.Scand J Gastroenterol. 2016; 51 : 410-419
- Avaliação molecular das diferenças no microbioma duodenal em indivíduos com síndrome do intestino irritável.Scand J Gastroenterol. 2015; 50 : 1076-1087
- Síndrome do intestino irritável: um distúrbio relacionado à microbiota intestinal ?.Am J Physiol Gastrointest Liver Physiol. 2017; 312 : G52-G62
- Envolvimento da microbiota associada à mucosa compartilhada no duodeno e reto na síndrome do intestino irritável com diarréia.J Gastroenterol Hepatol. 2018; 33 : 1220-1226
- O transplante de microbiota fecal de pacientes com síndrome do intestino irritável altera a função intestinal e o comportamento em camundongos receptores.Sci Transl Med. 2017; 9
- Funções intestinais, ácidos biliares não conjugados fecais primários e secundários e trânsito colônico em pacientes com síndrome do intestino irritável.Clin Gastroenterol Hepatol. 2013; 11 : 1270-1275 e1
- O receptor TGR5 medeia as ações procinéticas dos ácidos biliares intestinais e é necessário para a defecação normal em camundongos.Gastroenterology. 2013; 144 : 145-154
- O taurodeoxicolato modula a atividade apical de troca Cl- / OH- em células Caco2.Dig Dis Sci. 2007; 52 : 1270-1278
- O ácido chenodeoxicólico estimula a secreção de Cl (-) via sinalização de cAMP e aumenta a fosforilação do regulador de condutância transmembrana da fibrose cística em células T84.Am J Physiol Cell Physiol. 2013; 305 : C447-C456
- O sulfeto de hidrogênio como molécula sinalizadora que regula os processos fisiopatológicos da motilidade gastrointestinal.Br J Pharmacol. 2017; 174 : 2805-2817
- Respostas fisiológicas de neurônios mioentéricos de cobaias secundárias à liberação de serotonina endógena pela triptamina.Neurociências. 1985; 16 : 223-240
- Os efeitos dos gases metano e hidrogênio produzidos por bactérias entéricas na motilidade ileal e no tempo de trânsito colônico.Neurogastroenterol Motil. 2012; 24 ( e92 ) : 185-190
Informação do artigo
História da Publicação
Notas de rodapé
Conflitos de interesse Os autores não divulgam conflitos.
Identificação
direito autoral
Licença de Usuário
Atribuição Creative Commons - Não comercial - NoDerivs (CC BY-NC-ND 4.0) |ScienceDirect
Acesse este artigo no ScienceDirectBonecos
Mesas
Artigos relacionados
- Efeitos dos surfactantes aniônicos na estrutura e função da membrana do intestino delgado de hamster: relação com a atividade de superfícieGastroenterologiasetembro de 1977
- Efeito do bisacodil na estrutura e função do roedor e do intestino humanoGastroenterologiamaio de 1977
- Enteroides humanos como modelo de fisiologia e fisiopatologia do transporte de íons no intestino delgado superiorGastroenterologia8 de dezembro de 2015
- A sumoilação por Ubc9 regula o compartimento da célula-tronco, a estrutura e a função do epitélio intestinal em camundongosGastroenterologia15 de outubro de 2010
- Demarque et al.
- Fonte:https://www.cmghjournal.org/article/S2352-345X(19)30094-3/fulltext#relatedArticles
Imunidade e intestino: você conhece a relação?
Imunidade e intestino: você conhece a relação?
Publicado em 17 de fevereiro de 2021.
Nos últimos anos o intestino deixou de ser considerado um órgão responsável apenas pela digestão de alimentos e absorção de nutrientes, e vem ganhando destaque também por seu papel importante na modulação do sistema imunológico e na proteção do organismo contra estímulos (biológicos, químicos ou físicos) prejudiciais à saúde. Ainda, tem sido demonstrado que a função imunomoduladora do intestino depende da integridade da barreira intestinal e do funcionamento do tecido linfoide associado ao intestino, bem como de sua interação com a microbiota intestinal.1,2
Com uma área de aproximadamente 300 m2, o epitélio intestinal é a maior superfície mucosa do corpo humano, sendo formado por uma única camada de células organizadas em criptas e vilosidades. Uma vez que, através da ingestão de alimentos, o organismo humano está constantemente exposto a toxinas, antígenos e microrganismos patogênicos, o epitélio intestinal atua como uma barreira física, evitando que o conteúdo presente no lúmen intestinal se difunda para outros tecidos ou órgãos e comprometa a sua homeostase. Ainda, células epiteliais especializadas – como as células caliciformes e as células de Paneth – secretam glicoproteínas (mucinas) e peptídeos antimicrobianos para o muco intestinal, formando uma barreira química que impede a proliferação e disseminação de microrganismos patogênicos.1,2
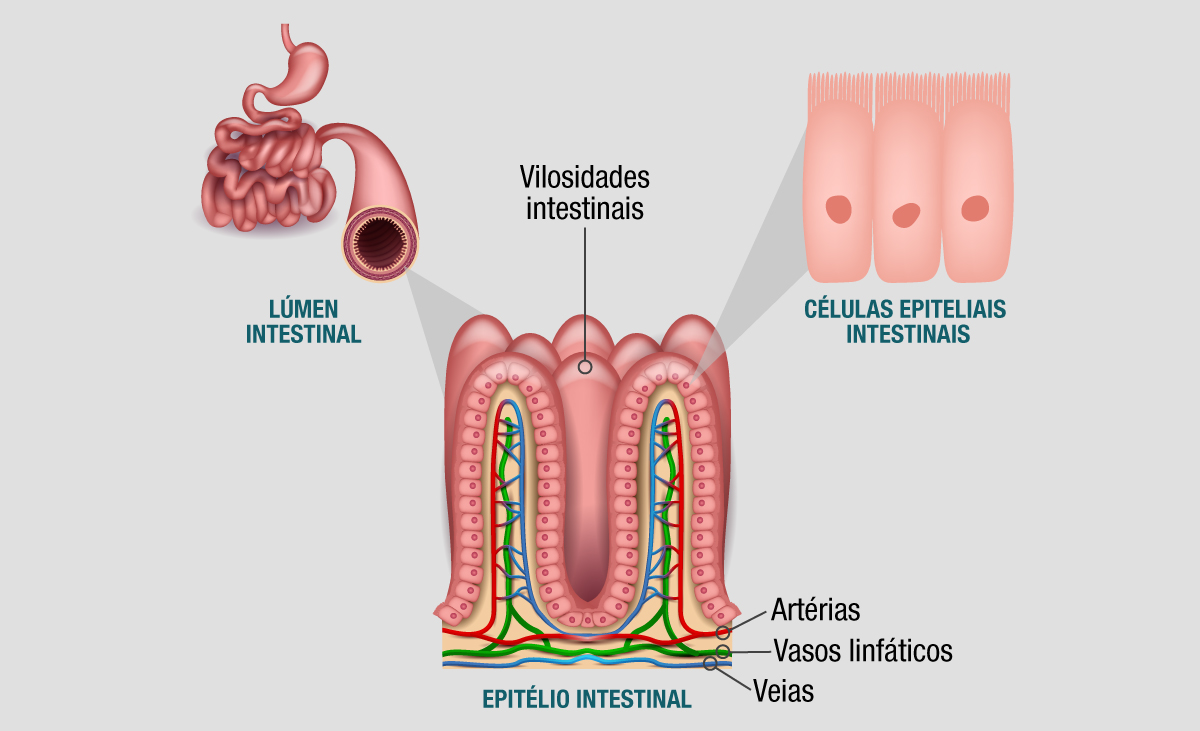 Representação anatômica do lúmen do intestino delgado, evidenciando as vilosidades na superfície do epitélio intestinal, as células epiteliais com sua microvilosidades, e a rede de vasos sanguíneos e linfáticos que irrigam este órgão.
Representação anatômica do lúmen do intestino delgado, evidenciando as vilosidades na superfície do epitélio intestinal, as células epiteliais com sua microvilosidades, e a rede de vasos sanguíneos e linfáticos que irrigam este órgão.Além disso, o tecido linfoide associado ao intestino (GALT, do inglês “gut-associated lymphoid tissue”) também contribui significativamente para a proteção do organismo, garantindo a eliminação de patógenos. O GALT é um componente do sistema imunológico localizado no trato gastrointestinal, mais especificamente na lâmina própria – tecido conjuntivo que se encontra abaixo do epitélio intestinal. É composto por linfócitos intraepiteliais, folículos linfoides isolados, Placas de Peyer e linfonodos mesentéricos, responsáveis pelo reconhecimento de antígenos presentes no lúmen intestinal, bem como pela síntese e liberação de citocinas, quimocinas e anticorpos.3,4
Os linfócitos intraepiteliais são linfócitos T localizados entre as células do epitélio intestinal que, além de estarem em contato direto com antígenos no lúmen intestinal, também se comunicam com extensões citoplasmáticas de células dendríticas envolvidas no reconhecimento, processamento e apresentação de antígenos. Os folículos linfoides isolados, por sua vez, são aglomerados de células imunes localizados imediatamente abaixo do epitélio intestinal. Já as Placas de Peyer são importantes para o início das respostas imunes adaptativas no GALT (produção de anticorpos e memória imunológica), sendo constituídas por um grande número de linfócitos T e B, macrófagos e células dendríticas, organizadas como folículos de linfócitos B com áreas intermediárias de linfócitos T.5-7
O epitélio intestinal que recobre tanto as Placas de Peyer quanto os folículos linfoides isolados possui um tipo especializado de células epiteliais (“Microfold cells”, ou células M), envolvidas no transporte de antígenos do lúmen intestinal, incluindo proteínas solúveis, partículas inertes e microrganismos. Desta forma, as células M permitem que as células dendríticas e macrófagos teciduais capturem estes antígenos para serem transportados até as Placas de Peyer e os folículos linfoides, desencadeando as resposta imunes.5-7
Por fim, os linfonodos mesentéricos também são constituintes importantes do GALT. São pequenos órgãos de formato oval (chamados de glândulas linfáticas) compostos por um grande número de linfócitos T e B envoltos em uma cápsula fibrosa, e também participam das respostas imunes adaptativas ao entrarem em contato com antígenos carreados através da linfa.5-7
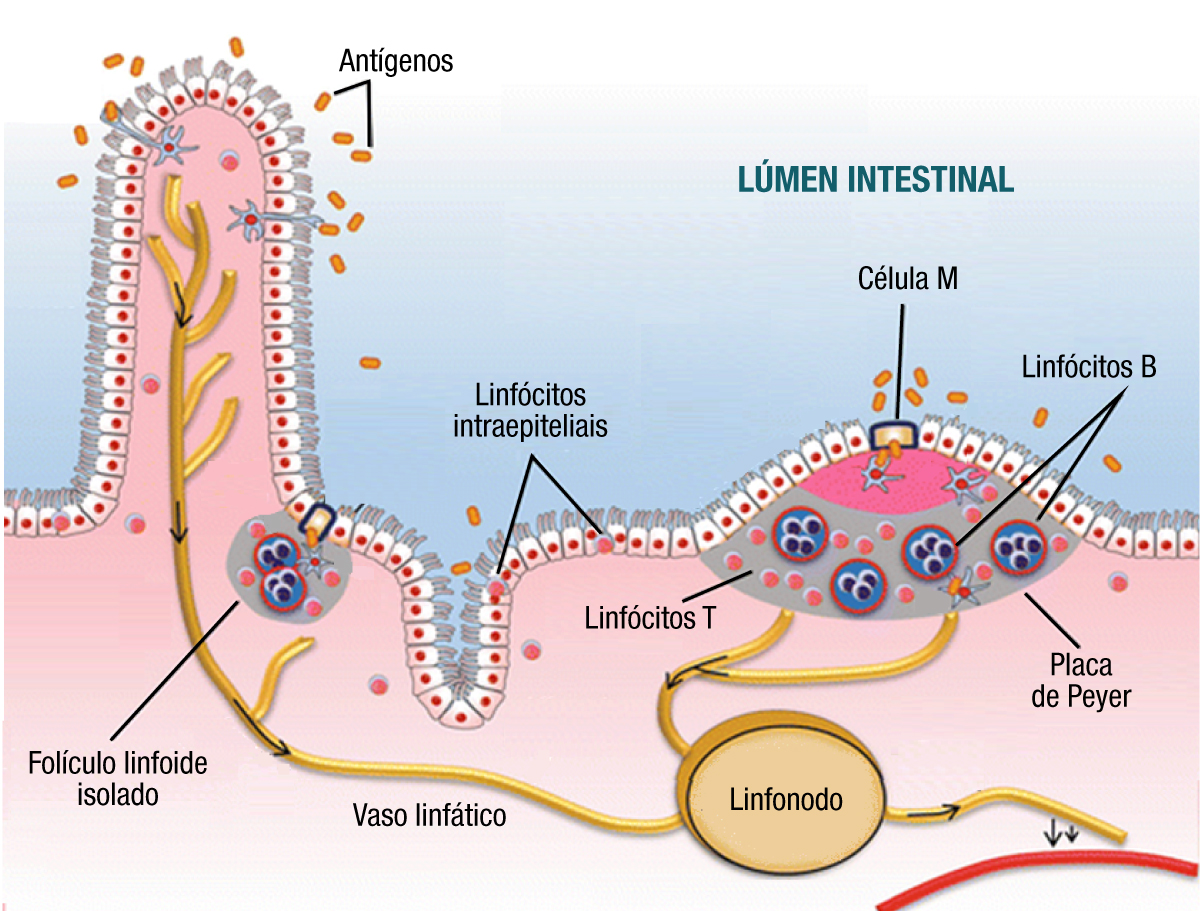
O tecido linfoide associado ao intestino (GALT) é composto por linfócitos intraepiteliais, folículos linfoides isolados, Placas de Peyer e linfonodos mesentéricos, responsáveis pelo reconhecimento de antígenos presentes no lúmen intestinal, bem como pela síntese e liberação de mediadores químicos e anticorpos envolvidos na regulação das repostas imunes
Além de desempenhar um papel importante na eliminação de microrganismos patogênicos e de antígenos provenientes do ambiente externo, o GALT também exerce um impacto significativo sobre a resposta imune sistêmica do organismo. Este efeito, por sua vez, é influenciado diretamente pela microbiota intestinal – composta por cerca de 160 espécies diferentes de microrganismos comensais (principalmente bactérias, mas também fungos, protozoários e vírus), que regulam inúmeras funções fisiológicas. Neste contexto, estudos vêm demonstrando que a microbiota intestinal estimula o desenvolvimento do GALT e, com isso, contribui para os processos de tolerância e memória imunológica.8,9,10
Ao serem translocados pelo epitélio intestinal através das células M, os antígenos de microrganismos que colonizam a microbiota intestinal são detectados por receptores de reconhecimento de padrões (PRRs) em células dendríticas e macrófagos teciduais, resultando na ativação de células do sistema imune inato e adaptativo presentes nos folículos linfoides isolados e nas Placas de Peyer. Desta forma, desencadeiam a síntese de anticorpos, citocinas e peptídeos antimicrobianos que auxiliam na neutralização de antígenos nocivos e patógenos, bem como no desenvolvimento de tolerância a microrganismos comensais e benéficos ao organismo humano. Este mecanismo contribui não apenas para a manutenção da homeostase intestinal como também para a melhora da resposta imune em todo o organismo, visto que algumas células do GALT podem migrar para tecidos distantes através dos linfonodos mesentéricos e, assim, exercer efeitos imunomoduladores sistêmicos.3,9-12
Por outro lado, a disbiose (desequilíbrio) da microbiota intestinal tem sido associada ao comprometimento das respostas imunes, que pode contribuir para o desenvolvimento de diferentes tipos de alergias e doenças autoimunes, incluindo artrite reumatoide e lúpus eritematoso sistêmico. Assim, cada vez mais a suplementação com probióticos emerge como uma intervenção terapêutica interessante já que, dentre outros efeitos, melhora a composição da microbiota intestinal e, como consequência, pode contribuir para a melhora das respostas imunes mediadas pelo GALT, resultando em diversos benefícios à saúde. Neste contexto, inúmeros estudos demonstram que a suplementação com diferentes espécies de microrganismos probióticos (incluindo bactérias dos gêneros Bifidobacterium e Lactobacillus) estimula as funções imunológicas, promovendo um aumento no número de linfócitos T imaturos responsivos a novos antígenos, bem como aumento da atividade de linfócitos NK e da fagocitose mediada por granulócitos.3,8,9,13,14-19
Por definição, probióticos são microrganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro. Entretanto, recentemente tem sido demonstrado que a suplementação com microrganismos inativados e não viáveis também é uma opção terapêutica eficaz no manejo de diferentes condições clínicas, visto que estimula o melhor funcionamento do sistema imunológico e das respostas de defesa do organismo. Além disso, apresentam um perfil de segurança adequado para administração em populações específicas, como indivíduos imunocomprometidos e pacientes pediátricos e neonatos.20

A linha SynbiOFF®
A linha SynbiOFF®FF® é composta por cepas probióticas isoladas de bactérias do gênero Lactobacillus (Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus plantarum e Lactobacillus rhamnosus) obtidas a partir de um processo de tratamento térmico denominado tindalização. Esse método de esterilização por calor úmido, semelhante à pasteurização, promove a inativação destes microrganismos sem afetar a integridade de suas membranas celulares.

As cepas de SynbiOFF® atuam por 3 mecanismos distintos para promover a melhora do funcionamento do sistema imunológico:
1. Mimetismo molecular e exclusão competitiva: uma vez que o tratamento térmico não interfere com a integridade da membrana celular, as cepas de SynbiOFF® aderem às microvilosidades do epitélio intestinal, inibindo a colonização e proliferação por patógenos;
2. Efeito prebiótico: SynbiOFF® restaura a homeostase da microbiota residente e promove o crescimento das espécies comensais, como Lactobacillus e Bifidobacterium;
3. Imunomodulação: as cepas de SynbiOFF® ativam a cascata de sinalização do sistema imune inato ao interagirem com os receptores de reconhecimento de padrões (PPRs) – especialmente os receptores toll-like (TLR) presentes na membrana de células epiteliais intestinais.
Desta forma, a suplementação com SynbiOFF® pode ser uma utilizada visando a prevenção e o tratamento de uma variedade de doenças, visto que promove diversos efeitos benéficos à saúde ao modular as respostas imunes no organismo.
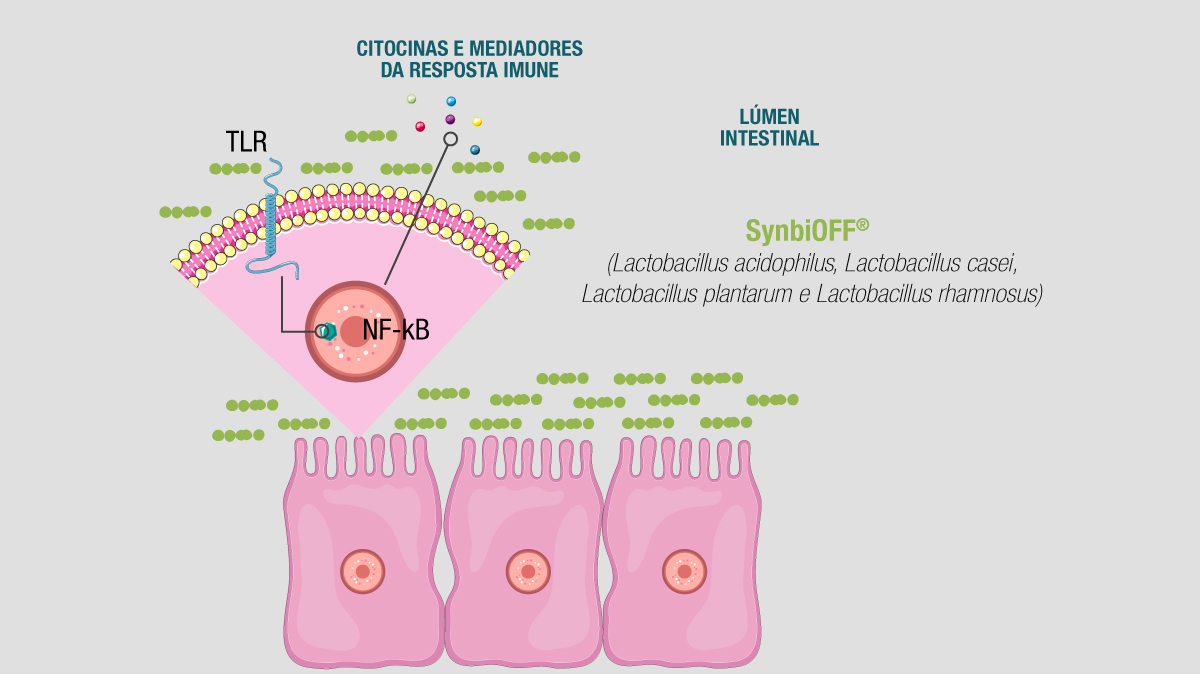 A interação entre as cepas de SynbiOFF® com receptores toll like (TLR) presentes na membrana das células epiteliais intestinais desencadeia a ativação de uma cascata de sinalização intracelular, mediada pela ativação do fator de transcrição NF-κB (fator nuclear kappa B), de proteínas quinases ativadas por mitógenos (MAPK) e de fatores de resposta ao interferon (IRFs). Com isso, promove o aumento dos níveis de interleucinas e outros mediadores químicos relacionados à resposta imune eficaz e coordenada.
A interação entre as cepas de SynbiOFF® com receptores toll like (TLR) presentes na membrana das células epiteliais intestinais desencadeia a ativação de uma cascata de sinalização intracelular, mediada pela ativação do fator de transcrição NF-κB (fator nuclear kappa B), de proteínas quinases ativadas por mitógenos (MAPK) e de fatores de resposta ao interferon (IRFs). Com isso, promove o aumento dos níveis de interleucinas e outros mediadores químicos relacionados à resposta imune eficaz e coordenada.As informações fornecidas neste blog destinam-se ao conhecimento geral e não devem ser um substituto para a orientação de um profissional médico ou tratamento de condições médicas específicas. As informações aqui apresentadas não têm o objetivo de diagnosticar, tratar, curar ou prevenir qualquer doença.
Prescritores e farmacêuticos que desejarem obter mais informações sobre os nossos insumos podem entrar em contato com o nosso SAC através do e-mail sac@activepharmaceutica.com.br ou pelo 0800 001 1313.
Siga nosso Instagram e acompanhe outros assuntos: @caldicmagistral.br
Fonte:https://magistralbr.caldic.com/blog/imunidade-e-intestino-voce-conhece-a-relacao
nes.7

Comentários
Postar um comentário