Sistema imune do intestino delgado: conceitos atuais
Natália Oliveira e Silva e Ulysses Fagundes Neto
Introdução
O tubo digestivo encontra-se constantemente exposto aos fatores do meio ambiente, como por exemplo, microrganismos e antígenos da dieta. Por esta razão, ocorre uma interação entre os microrganismos do interior do tubo digestivo e do ambiente externo, a qual exerce uma importante influência na saúde do hospedeiro. O sistema imune do intestino é capaz de reagir aos microrganismos agressores e mantém-se tolerante aos microrganismos pertencentes à microbiota do intestino e, também, aos antígenos presentes na dieta.
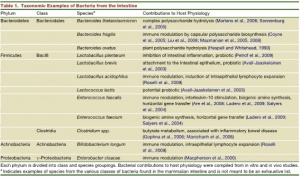
O intestino humano abriga uma estimativa de 100 trilhões de microorganismos, sendo que a grande maioria é composta por bactérias, envolvendo de 500 a 1.000 espécies diferentes, e, 99% do total correspondem de 30 a 40 espécies de bactérias, a imensa maioria delas anaeróbia.
A denominação microbiota intestinal refere-se justamente a essa comunidade microbiana presente no intestino, que inclui os seguintes grupos bacterianos, a saber: Bifidobacteria, Enterobacteria, Clostridia, Lactobacillus e Enterococo. Este conjunto de bactérias encontra-se frequentemente presente, mas não obrigatoriamente, no intestino grosso de indivíduos adultos saudáveis. Essa microbiota pode variar de acordo com muitos fatores, tais como local colonizado e idade do hospedeiro, entre outros. Por exemplo, no primeiro ano de vida, a microbiota é menos estável que a do adulto.
A colonização bacteriana do intestino do neonato depende do tipo de parto, da dieta (leite materno ou fórmula láctea), da flora bacteriana materna, além das condições de higiene. O uso de antibióticos também determina alterações importantes, tanto na quantidade quanto no tipo de colonização.
Distribuição da Microbiota Intestinal
Em relação à microbiota do intestino delgado, o duodeno e o jejuno devem conter um total inferior a 104-106 de colônias. Nesta região do trato digestivo ocorre uma comunidade microbiana transitória, caracterizada por bactérias Gram+, derivadas dos alimentos ingeridos, diferentemente da microbiota do colon, que é persistente (Tabela 1).
Essa população bacteriana proporciona uma série de contribuições chave para a saúde do hospedeiro, tais como:
- Melhora da digestão;
- Auxílio no desenvolvimento do sistema imune;
- Limita a colonização patogênica através de competição por espaço e nutrientes.
A participação da microflora no sistema imune inclui:
Ativação: qualquer perturbação no estabelecimento da microflora refletirá no equilíbrio da microbiota, e, consequentemente na ativação do sistema imune;
- Modulacão: as Bifidobacterias por exemplo estimulam a resposta imune protetora;
- Regulação: supressão da resposta imune por meio de tolerância oral, com redução das respostas humoral e celular.
A interação entre a microbiota intestinal e o hospedeiro envolve uma relação que pode ser:
Simbiótica: neste caso ambos os organismos se beneficiam mutuamente. A relação de simbiose é dependente da limitação da penetração das bactérias nos tecidos, portanto representa um desafio para o hospedeiro, pois existe uma linha tênue entre mutualismo e patogenicidade. Vale ressaltar que a composição da flora intestinal é dinâmica e pode variar com localização geográfica, estado nutricional e status imunológico;
- Patológica: isto ocorre quando um organismo se beneficia às custas do prejuízo do hospedeiro;
- Comensal: nesta situação um dos organismos é beneficiado, porém, sem prejudicar o outro.
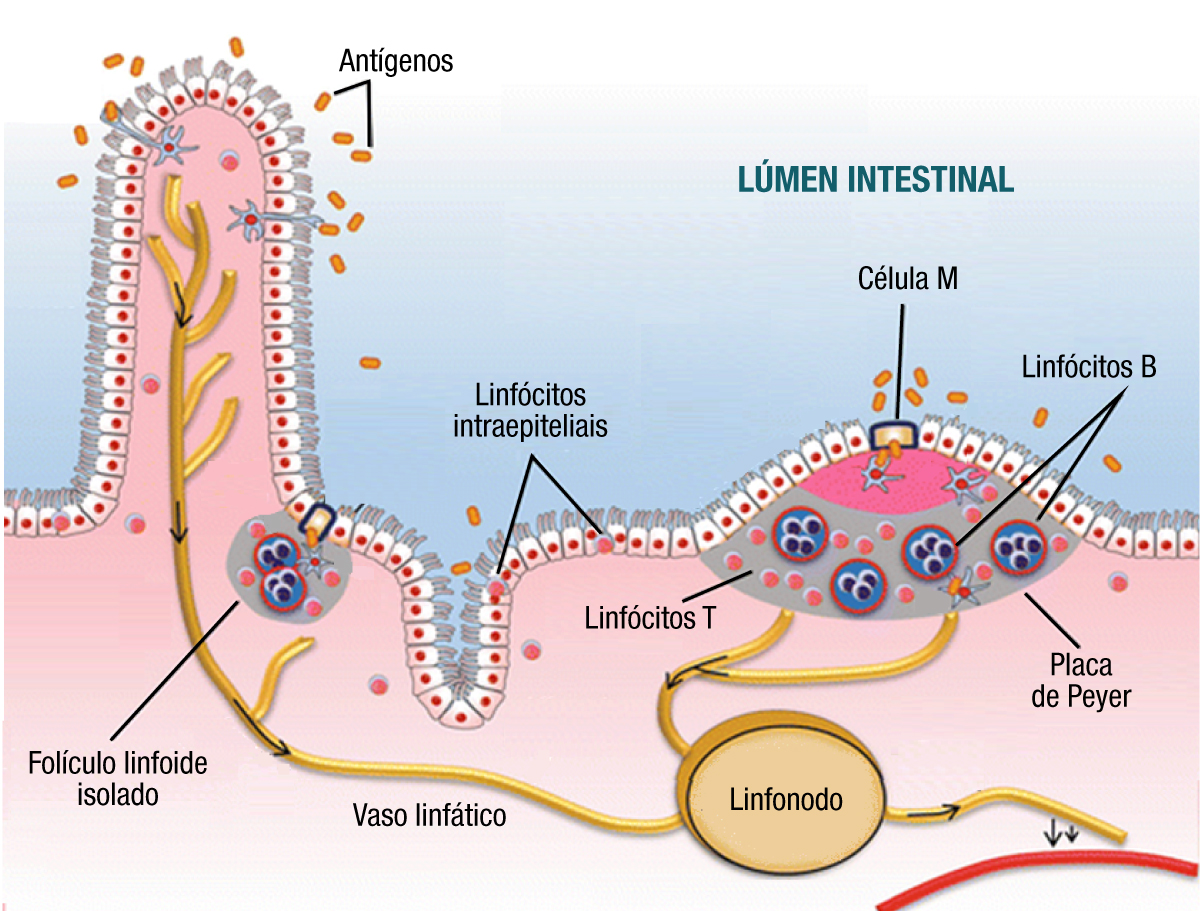
GALT (gut-associated lymphoid tissue) (tecido linfoide associado ao intestino)
Existe uma interação dinâmica entre a microflora intestinal, o epitélio intestinal e o sistema imune da mucosa intestinal, que deve sempre resultar em um equilíbrio para o hospedeiro. O sistema imune da mucosa constitui uma barreira imunológica intestinal que é formada pelas imunoglobulinas e pelo GALT.
A composição do GALT inclui os seguintes componentes, a saber:
- Tecido linfoide difuso: apêndice cecal e folículos linfoides solitários;
- Tecido linfoide organizado: placas de Peyer e células M.
Classificação do sistema imune intestinal
O sistema imune intestinal pode ser dividido em duas categorias: inato e adaptativo.
O sistema imune intestinal exerce papel importante para o equilíbrio entre a microbiota intestinal e o hospedeiro. É responsável pela defesa contra os microrganismos patogênicos: reações iniciais (imunidade inata) e pelas respostas tardias (imunidade adquirida).
Imunidade inata
É constituída por barreiras químicas e físicas, tais como:
- Epitélio, acidez gástrica, camada de muco, microbiota intestinal;
- Células fagocitárias: granulócitos, macrófagos, células NK;
- Sistema complemento e citocinas.
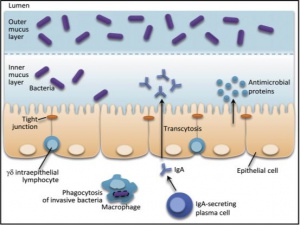
Epitélio intestinal
Este tipo de imunidade representa a interface entre o hospedeiro e a microbiota comensal, atua como barreira física, separando agentes altamente imunogênicos do lúmen intestinal de outros imunoreativos da submucosa. Expressa múltiplos receptores para detectar a presença de bactérias patogênicas e comensais. Além disso, produz moléculas antimicrobianas como alfa e beta defensinas, lecitinas, dentre outras.
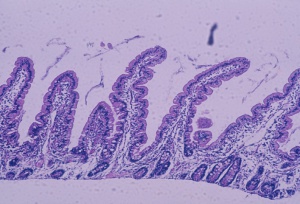
Figura 1- Microfotografia em microscopia óptica comum em aumento médio da unidade morfológica da mucosa do intestino delgado vilosidade/cripta. As vilosidades são digitiformes e as criptas estão abaixo das vilosidades, e a relação vilosidade/cripta normal deve ser 4/1.
Fatores que contribuem para manter baixa a carga de bactérias:
- Peristaltismo: previne a estase de nutrientes e bactérias
- Muco: mecanismo de barreira
- Secreção de substâncias antibacterianas pelo epitélio
O epitélio intestinal é composto por 4 linhagens de células (Figuras 1-2-3 – 4):
- Enterócitos: responsáveis pela absorção
- Células caliciformes: regulam a produção de muco
- Células enteroendócrinas
- Células de Paneth: produção de peptídeos antimicrobianos
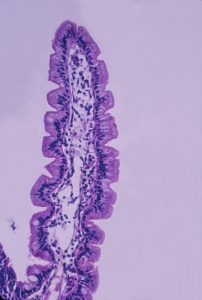
Figura 2- Microfotografia em microscopia óptica comum em grande aumento de uma vilosidade. As células epiteliais (enterócitos) são cilíndricas com núcleo em posição basal interpostas lado a lado formando uma verdadeira paliçada.
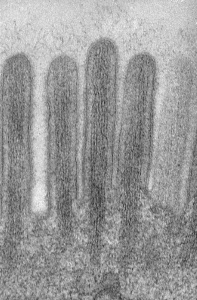
Figura 4- Ultramicrofotografia em grande aumento da região das microvilosidades do enterócito, destacando os tufos que emergem dos mesmos que servem de apoio para a camada de muco que irá conferir proteção ao enterócito contra as agressões do meio ambiente.
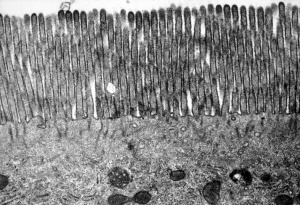
Figura 3- Ultramicrofotografia em grande aumento de um enterócito e a região das microvilosidades, a porção mais externa do enterócito em direto contato com o lúmen intestinal.
Enterócitos
Os enterócitos desempenham importante papel no processamento final dos nutrientes e na sua absorção. Eles possuem junções celulares especializadas (complexo juncional), que influenciam na permeabilidade da barreira intestinal. Além disso, os enterócitos tem participação nos mecanismos imunológicos, posto que sintetizam citocinas e quimiocinas, as quais atuam na transdução de sinais inflamatórios e, também, podem agir como células apresentadores de antígenos (Figuras 5- 6).
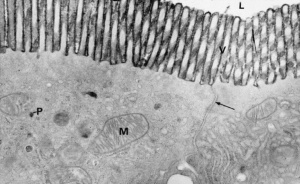
Figura 5- Ultramicrofotografia em grande aumento de 2 enterócitos adjacentes evidenciando a junção firme (seta) poro extremamente seletivo dando passagem apenas a água e eletrólitos.
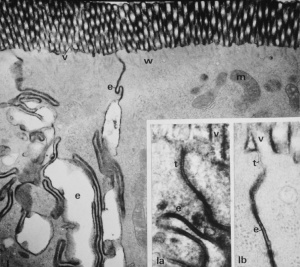
Figura 6- Ultramicrofotografia em grande aumento evidenciando 2 enterócitos adjacentes submetidos a diferentes situações experimentais: 1a- mostra a ruptura da barreira de permeabilidade caracterizada pela mancha enegrecida ao longo de todo o espaço intercelular; 1b- evidencia a preservação da junção firme em situação experimental fisiológica.
Células M
Estas são células epiteliais membranosas, especializadas na captura de antígenos para serem oferecidas aos tecidos linfóides da mucosa intestinal.
Células caliciformes
Estas células são especializadas na secreção do muco que recobre a superfície das vilosidades, e tem por função dificultar a penetração de agentes patogênicos. Além disso, protegem as células epiteliais das enzimas digestivas e lubrificam sua superfície (Figura 7).
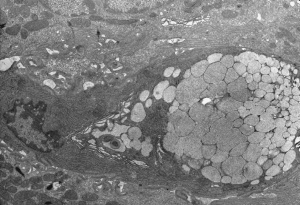
Figura 7- Ultramicrofotografia em grande aumento mostrando uma célula caliciforme repleta de muco em seu interior.
Células de Paneth
Estas células estão presentes na base das criptas do intestino delgado, e, em maior concentração no íleo terminal. Elas são responsáveis pela maior produção de proteínas antimicrobianas do intestino delgado, tais como, as lisozimas, a-defensinas, fosfolipase A2 e lecitina. Tem sido demonstrado que estas células tem um mecanismo autônomo para detecção de bactérias com potencial invasivo, além de fungos, protozoários e vírus.
Macrófagos
Eles são responsáveis pela rápida eliminação de microrganismos que penetram na barreira mucosa, posto que atuam na fagocitose e destruição destes patógenos que penetram na lâmina própria.
Enzimas digestivas
Incluem enzimas gástricas, pancreáticas e da borda em escova. Estas enzimas apresentam papel de destaque na proteólise, que é um mecanismo eficaz para diminuir a possibilidade de absorção de proteínas capazes de desencadear reações alérgicas.
Imunidade adaptativa
Este sistema envolve os linfócitos, os quais proporcionam proteção duradoura após exposição ao antígeno, e, se dividem 2 grupos, a saber:
- Humoral: mediada por linfócitos B e anticorpos produzidos por eles;
- Celular: mediada por linfócitos T e citocinas.
Imunidade humoral
A resposta humoral do intestino é caracterizada pela produção de IgA no epitélio e sua secreção no lúmen intestinal. Trata-se da imunoglobulina mais abundante da mucosa (80-90%), ela é sintetizada na lâmina própria em resposta à ativação dos linfócitos T das placas de Peyer. Estruturalmente, existem 2 isoformas de IgA, a monomérica e a polimérica. A IgA polimérica secretada é resistente à proteólise intraluminal e tem importante papel no desenvolvimento da tolerância, no lúmen intestinal. A IgA pode formar imunecomplexos com os antígenos alimentares ou com patógenos, neutralizando-os e evitando sua penetração. Além disso, inibe a proliferação viral dentro do enterócito e neutraliza as enterotoxinas.
A IgA pode também atuar a nível intraepitelial e subepitelial, captando os antígenos que atravessam a barreira intestinal. A criança apresentará o mesmo número de células produtoras de IgA do adulto quando atingir 1-2 anos, período que a microbiota se torna semelhante à do adulto.
Imunidade cellular
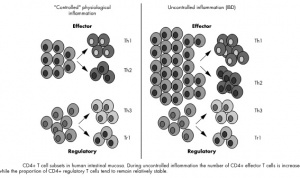
A imunidade celular é mediada pelos linfócitos T e seus subprodutos. Os linfócitos T CD4+ são classificados em 2 subtipos, e são relacionados da seguinte forma com a inflamação da mucosa intestinal, a saber:
- Tipo Th1, caracteriza-se por inflamação transmural e granulomatosa, como no caso da Doença de Crohn;
Tipo Th2 é caracterizada por inflamações superficiais com exsudato celular inflamatório agudo e edema da mucosa, como ocorre na colite ulcerativa.
Para evitar responder aos antígenos da dieta e à microbiota, o sistema imune do intestino exerce uma ação de supressão, que envolve tanto a tolerância oral, quanto o equilíbrio entre a resposta Th1/Th2, que são importantes fatores para evitar uma resposta imune inapropriada. Um dos mecanismos existentes para promover o equilíbrio entre tolerância e imunidade envolve a presença das células T reguladoras (Treg), que podem suprimir ativamente respostas antígeno-específicas. As células Treg são importantes no controle da resposta imune a antígenos do próprio indivíduo, evitando a autoimunidade e para manter a tolerância.
Linfócitos intraepiteliais
A resposta celular envolve os linfócitos intraepiteliais (LIE) que atuam na manutenção da integridade do epitélio intestinal. Estes localizam-se nos espaços intraepiteliais do intestino, onde são expostos a uma variedade de antígenos microbianos e alimentares. Um subtipo dos LIE, os linfócitos gama-delta, parecem desempenhar importante papel na tolerância oral. Os LIE gama-delta também contribuem com a imunidade adaptativa, restaurando a homeostase da mucosa após um dano ao epitélio, pois promovem o reparo do epitélio através da secreção de fatores de crescimento epitelial. Expressam fatores próinflamatórios e antimicrobianos em resposta a sinais da microbiota, e, consequentemente, atuam na limitação da penetração bacteriana na mucosa lesionada (Figura 8).
Barreira de Permeabilidade Intestinal e suas possíveis alterações
O intestino constitui a maior interface entre o ser humano e o meio ambiente, e a existência de uma barreira intestinal intacta é, portanto, essencial na manutenção da saúde e na prevenção de doenças. A barreira intestinal possui vários componentes imunológicos e não imunológicos, sendo que a barreira epitelial é um dos componentes não-imunológicas mais importantes. A hiperpermeabilidade desta barreira pode contribuir para a patogênese de várias doenças gastrointestinais incluindo a alergia alimentar, doença inflamatória intestinal e doença celíaca.
Alergia alimentar
Algumas situações podem alterar os mecanismos protetores da barreira de permeabilidade intestinal e colocar em risco a tolerância oral e aumentar a suscetibilidade para o desenvolvimento de alergias alimentares. Dentre estas possíveis situações deve-se considerar o aumento da permeabilidade da barreira intestinal e a baixa atividade enzimática, que são observadas em recém-nascidos, lactentes e desnutridos. Outro fator deve-se à diminuição da secreção ácida gástrica por uso de medicamentos, posto que estes podem alterar a microbiota e reduzir a proteólise. Também deve-se considerar as inflamações intestinais que acarretam lesões vilositárias com consequente aumento da permeabilidade intestinal.
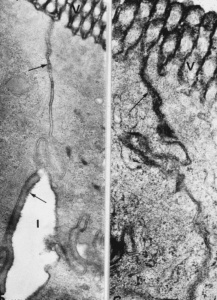
Figura 9- Ultramicrofotografia em grande aumento de 2 espécimes de enterócitos que sofreram diferentes tipo de tratamento experimental: 1- o da esquerda recebeu tratamento fisiológico pode-se observar 2 enterócitos adjacentes com o espaço intercelular preservado (seta); 2- o da direita foi submetido a uma experimentação para romper a barreira de permeabilidade e permite observar a mancha enegrecida que corresponde a um produto de reação de uma proteína intacta ao longo do espaço intercelular.
Doenças inflamatórias intestinais
No passado, muitos modelos experimentais responsabilizavam diversos agentes infecciosos como causa e fatores de exacerbação das doenças inflamatórias intestinais (DII). Estes estudos limitavam-se a serem observacionais e não eram investigados laboratorialmente. Por outro lado, atualmente, vem sendo investigada a perda da tolerância imune aos comensais bacterianos entéricos. Foi aventada a existência de uma hipótese que é fortemente justificada pela observação da peculiar flora entérica dos pacientes portadores de DII, a qual caracteriza-se por um aumento do número de bactérias agressivas, tais como Bacteroides, E. coli invasora e Enterococcus, e, também, por uma diminuição das bactérias protetoras, tais como, Lactobacillus e bifidobactérias.
Evidencias crescentes indicam que uma desregulação do sistema imune, geneticamente determinada, contra a flora bacteriana residente possa estar envolvida na patogênese das DII, porque biópsias realizadas neste grupo de pacientes, observaram-se que células T CD4+ representam a vasta maioria de células mononucleares infiltrando o intestino. Estes achados indicam que estas células CD4+ têm papel fundamental na patogênese do dano tissular na DII, especialmente na doença celíaca. Trata-se de um mecanismo que acarreta a ativação descontrolada de células T, mas que ainda não está completamente elucidado. Acredita-se que moléculas contra-reguladoras (TGF beta1, IL-10), envolvidas em manter a tolerância contra a flora residente apresentam uma atividade defeituosa (Figura 6).
Doença de Crohn: um modelo de suscetibilidade genética
A suscetibilidade genética do hospedeiro, ganhou destaque após a descoberta da associação da doença de Crohn com mutações do gene NOD2. Pacientes com defeitos no NOD2 tem redução na expressão de alfa-defensinas antimicrobianas nas células de Paneth, com consequente alteração no reconhecimento bacteriano e controle da inflamação. Estas observações sugerem que o produto do gene NOD2 confere suscetibilidade à doença de Crohn, documentando assim um modelo molecular para o mecanismo patogénico da doença de Crohn, que pode agora ser adicionalmente investigado.
Tradicionalmente, a doença de Crohn tem sido associada a um perfil de citocinas Th1, enquanto que as citocinas Th2 são moduladores da colite ulcerativa. Este conceito tem sido desafiado pela descrição de células T reguladoras (Treg) e por células Th17 pró-inflamatórias, uma nova população de células T, caracterizada pela produção de citocinas pró-inflamatórias e quimiocinas. Vários estudos demonstraram um papel importante das células Th17 na inflamação intestinal, particularmente na doença de Crohn. Investigações de associação do genoma indicam que existem genes envolvidos na diferenciação Th17 que estão associados com a susceptibilidade à doença de Crohn e em parte também com colite ulcerativa. Tomadas em conjunto, as células Th1 e Th17 são mediadoras importantes da inflamação na doença de Crohn. Estas investigações iniciais poderão levar ao conhecimento mais preciso do mecanismo de produção das DII.
Conclusões
Atualmente está plenamente demonstrado o papel fundamental do sistema imune intestinal na regulação do equilíbrio entre o organismo do hospedeiro e a microbiota que habita seu trato digestivo, evitando que ocorram situações patológicas em detrimento do bem estar de saúde do hospedeiro. Trata-se de um sistema altamente sofisticado que necessita a interação de inúmeros fatores para a preservação da sua total integridade.
Até o presente momento há pouco consenso sobre o possível papel de proteção da barreira intestinal para a prevenção ou tratamento das DII. No entanto, várias medidas de protecção têm sido utilizados para melhorar a função de barreira intestinal, como uso de antioxidantes, o fator de crescimento e a nutrição enteral.

Comentários
Postar um comentário